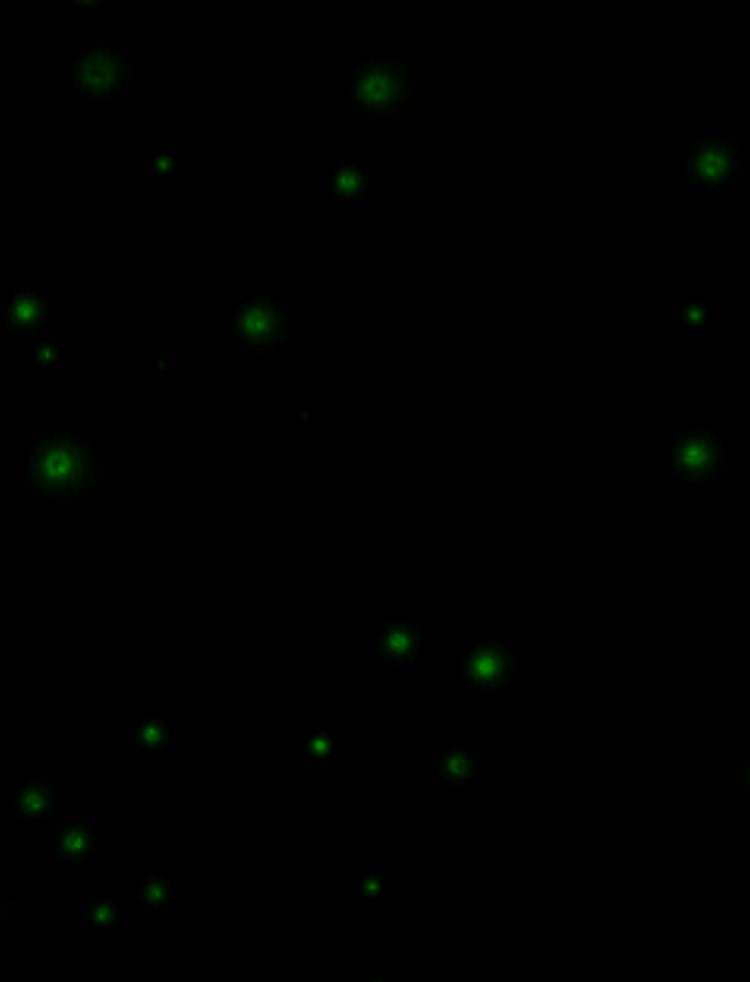
다양한 세포 유형에 걸쳐 자동화 스크리닝 및 객관적인 High Value Clone의 객관적인 선택을 위한 완벽한 솔루션.
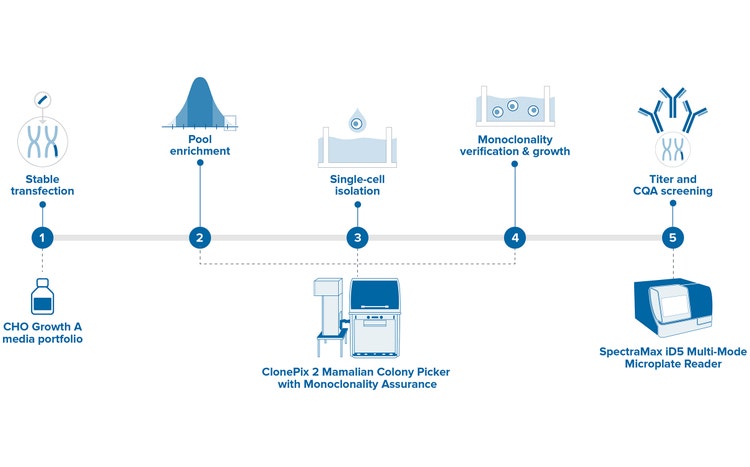
ClonePix® 2 Mammalian 콜로니 피커는 항체 발굴과 Cell Line Development에 사용되는 High-Value 클론을 선택하기 위한 완전 자동화 시스템입니다. 0일차에 더 짧은 단일클론 검증 시간 동안 더 많은 클론을 스크리닝하고, 몇 달이 아닌 단 몇 주 만에 가장 생산량이 많은 클론을 스크리닝하여 식별합니다.
하이브리도마, CHO 세포, 줄기 세포, 다른 세포 유형의 경우 사용자 지정 Parameter에 기반하여 이미징 및 선택됩니다. 플레이트 취급, 바코드 판독, 피킹 모두가 완전히 통합됩니다. 그리고 이미지를 포함한 모든 데이터는 다운스트림 분석을 위해 저장됩니다. 이 피커는 최적 생산 세포주의 발견 확률을 높이며 상당한 시간과 노력을 절감할 수 있도록 합니다.

항체 발굴 및 Cell line development 실험과정 자동화
ClonePix 2 피커는 노동집약적인 한계 희석법과 FACS보다 10배 더 빠릅니다. 당사의 정교한 소프웨어와 통합 로보틱스로 일일 10,000개가 넘는 클론 스크리닝 속도가 가능합니다.

0일차에 monoclonality를 보장하는 원하는 속성을 가진 세포 선택하기
단백질 생산성, 항원 특이성, cell viability, 태그 재조합 단백질의 발현 수준에 기반하여 쉽게 클론을 스크리닝하여 선택하십시오.

불안정 상태의 클론을 조기에 제거하거나 복구하는 동시에 고가치 클론의 식별 확률 증가
1mm 미만의 피킹 정확도. 로봇 피킹은 콜로니 이상 위험을 감소시킵니다. 피킹된 클론의 이미지는 데이터와 함께 저장됩니다.

ClonePix 2
기능

다중 검출 방법
백색광은 클론 형태, 크기, 근접성을 식별 및 측정합니다. 형광은 발현 수준 및/또는 특이성을 나타냅니다. 최대 5개의 형광 필터를 다목적으로 사용 가능합니다.

멸균 유지관리
기기 내부의 위생처리, 핀 세척 및 할로겐 건조를 위한 UV 광선을 포함한 여러 표준 멸균 기능 및 옵션이 있습니다.

통합된 플레이트 저장소
각각 용량이 플레이트 10개인 원 플레이트와 대상 플레이트용 두 개로 구성된 저장 스택을 포함합니다.

독립된 콜로니 형성
반고형 CloneMediaTM은 단일 세포가 독립적 콜로니로 생장하도록 하며, 편리하게 플레이팅할 수 있도록 합니다. 이 배지에서는 스크리닝할 클론 밀도가 더 높습니다.

동물성 성분 무첨가 배지 및 시약
화학적으로 조성되고 동물성 성분이 무첨가된 CloneMedia 세포 배양 배지는 생산성을 높이고 CloneDetect TM 검출제를 사용하여 분비된 항체를 시각화하는 데 최적화되어 있습니다.

맞춤형 자동화 옵션*
고급 실험과정 엔지니어링 솔루션 팀은 monoclonality 시스템을 맞춤화하고 monoclonality의 통합적 검증과 같은 추가적인 서비스를 제공합니다.
Transformation시킨 Cell Linve Development 실험과정을 사용하여 클론 스크리닝과 선택을 재정의합니다.
In situ에서 생성된 일련의 이미지에서 클론 맵과 클론의 분비 수준에 대한 자동 생성된 데이터를 분석하여 연구팀의 역량을 강화하세요. 또한 ClonePix에서 0일차에 이미지 기반 monoclonality 보장을 포함하도록 사용자 정의할 수 있습니다.* 즉, 연구팀은 스크리닝을 1회 수행한 다음 몇 달이 아닌 단 몇 주 만에 가장 생산량이 많은 클론을 피킹할 수 있습니다.
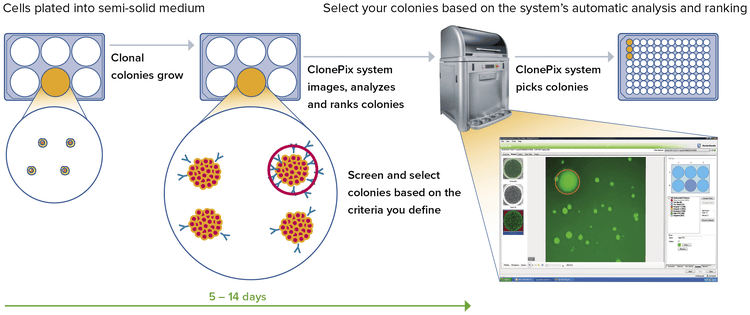
데이터 분석 및 추적 - 안정 상태의 클론을 더 빠르게 표시
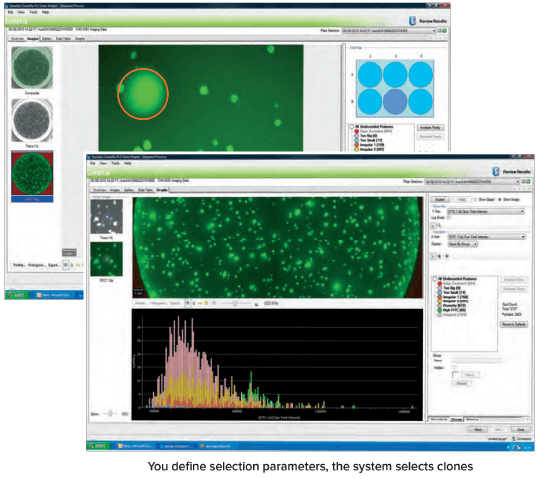
데이터 분석
- In situ 생성된 일련의 이미지에서 클론의 2D 맵과 클론의 분비 수준에 대한 데이터를 자동으로 생성합니다.
- 다음에 따라 콜로니를 스크리닝 및 선택:
- Size, roundness, and proximity to neighbors
- Ranking according to fluorescence levels
- Closely placed colonies ignored via user-controlled “proximity” software setting
데이터 추적
각 콜로니와 관련된 모든 관련 데이터(피킹 좌표와 함께 피킹 전후에 촬영한 이미지 포함)는 리뷰 및 다운스트림 분석을 위해 자동으로 저장됩니다.
Enhanced for Monoclonality Verification*
Offering high-resolution single-cell imaging capability on day 0
The enhanced ClonePix 2 system can automatically screen and pick clones that are both high-producing and monoclonal—all in one system. Screen more clones in less time with monoclonal verification on day zero, then screen and pick the highest producers in less than two weeks.
Key Benefits:
- Rapid Monoclonal Verification: Achieve image-based clonality verification on day zero, reducing screening rounds from two to one.
- Advanced Imaging Capabilities: Rapid Z-stack acquisition allows detection of single cells throughout the medium volume, not just a single focal plane.
- Streamlined Workflow: Simplified process from single-cell identification to productivity screening, enhancing efficiency with the all-in-one system.
- Higher Throughput: Process up to 12,000 colonies on just 10 plates, significantly increasing laboratory productivity.
- Cost-Effective Operations: Minimize operational costs through reduced manual labor, decreased media volume requirements, and enhanced processing speed.
줄기 세포 응용 분야를 위해 향상됨*
High-throughput 콜로니 스크리닝 및 피킹에 적합한 클론 줄기 세포 콜로니 식별
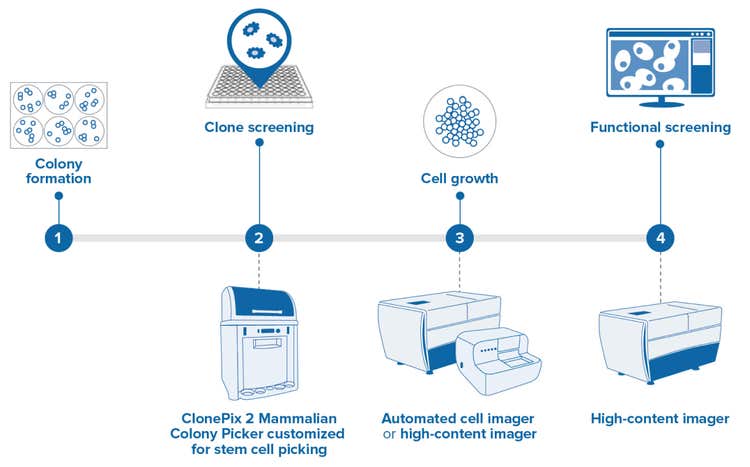
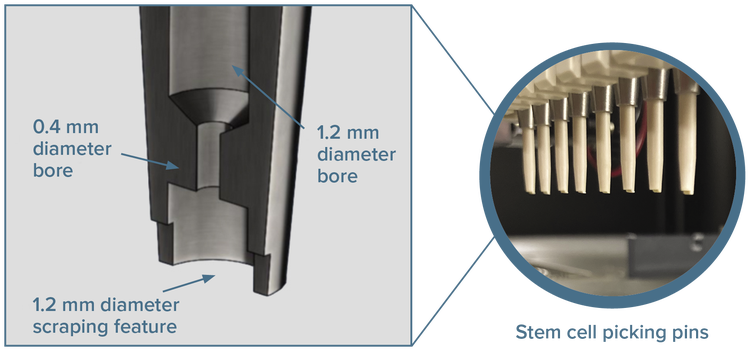
High-resolution imaging은 high-throughput 콜로니 스크리닝 및 피킹에 적합한 클론 줄기 세포 콜로니를 식별합니다. 특수 피킹 핀을 사용하면 클론 확장 및 다운스트림 분석을 위해 피더프리(feeder-free) 부착 세포를 고밀도 플레이트로 부드럽게 이동시킬 수 있습니다.
- 콜로니 형성 6 Well 플레이트에 낮은 밀도로 플레이팅한 개별 줄기 세포가 분열하여 콜로니로 발달합니다. 콜로니가 단일 모세포에서 유래되도록 플레이이팅 밀도를 낮게 유지합니다.
- 클론 스크리닝 - 클론 유래 줄기 세포 콜로니를 적합한 형태학적 특성으로 식별하며, 저밀도 6 Well 플레이트부터 더 높은 밀도의 96 Well 플레이트까지 피킹하여 스크리닝을 계속합니다. ClonePix® 2 포유류 콜로니 피커는 high-resolution 광학적 장치 및 줄기 세포 특이적 핀을 사용하여 맞춤화할 수 있으므로 이와 같이 확립된 기술을 줄기 세포 실험과정에 활용할 수 있습니다.
- Cell Growth - Cell Growth는 주어진 기간 동안 Label Free Imaging으로 세포 분열을 모니터링하여 결정합니다
- 기능적 Screening - 성장을 Monitoring하는 것 외에도 기능적 세포 기반 Assay를 수행할 수 있습니다. 여기에는 분화 가능성, 다능성, 3D 오가노이드 형성능 및 기타 적합한 특성을 평가할 수 있는 assay를 포함할 수 있습니다.
ClonePix Kits
Additionally, consider integrating our specialized ClonePix Reagent Kits to further enhance your system's capabilities. These kits provide optimized media for CHO cell line development and convert existing media to semi-solid form, ensuring colony integrity and enabling fast screening and high-value clone selection.

*가격, 배송 기간, 사양은 상호간에 동의한 기술적 요구 사항에 따라 달라집니다. 솔루션 요구 사항으로 인해 표준 성능이 조정될 수 있습니다.
맞춤형 솔루션에는 Molecular Devices의 맞춤형 제품 구매 약관이 적용됩니다.
자주 묻는 질문(FAQ)
ClonePix 2 포유동물 콜로니 피커란?
ClonePix 2 포유동물 콜로니 피커는 포유동물 콜로니에 대한 효율적이고 자동화된 선택을 위해 Molecular Devices가 개발한 최첨단 기술입니다. 이는 클론 스크리닝 프로세스를 간소화하여 연구자가 다운스트림 응용 분야를 위한 고가치 클론을 신속하게 식별하고 분리할 수 있도록 합니다.
ClonePix 2 포유동물 콜로니 피커는 어떻게 작동하나요?
ClonePix 2 포유동물 콜로니 피커는 고급 Imaging과 로봇 기술을 사용하여 개별 포유동물 콜로니를 분석하고 피킹합니다. 콜로니의 High-Resolution 이미지를 캡처하고 기본 설정된 기준에 따라 부드럽고 정확한 피킹 메커니즘을 사용하여 원하는 클론을 선택하고 피킹합니다. 이 자동화된 프로세스는 시간을 절약하고 수동 콜로니 피킹과 관련된 인적 오류를 줄입니다.
ClonePix 2 포유동물 콜로니 피커의 주요 기능은 무엇인가요?
ClonePix 2 포유동물 콜로니 피커는 고속 Imaging, 사용자 정의 가능한 콜로니 피킹 Parameter, 유연한 플레이트 형식, 사용자 친화적인 인터페이스를 포함한 여러 주요 기능을 제공합니다. 또한 콜로니 수준의 데이터 분석을 제공하여 연구자가 클론 선택 중에 정보에 입각한 결정을 내릴 수 있도록 해줍니다.
ClonePix 2 포유동물 콜로니 피커를 사용하면 어떤 이점이 있나요?
ClonePix 2 포유동물 콜로니 피커는 다양한 이점을 제공합니다. 클론 스크리닝에 소요되는 시간과 노력을 대폭 줄여 생산성을 향상시킵니다. 수동 처리 오류를 제거하여 정확성과 재현성을 향상시킵니다. 또한 이를 통해 연구자가 희귀하고 가치 있는 클론을 식별할 수 있어 다운스트림 응용 분야의 성공률이 높아집니다.
ClonePix 2 포유동물 콜로니 피커는 어떤 응용 분야에 사용할 수 있나요?
ClonePix 2 포유동물 콜로니 피커는 항체 개발, Cell Line Development, 단백질 발현 최적화, 유전 공학과 같은 다양한 응용 분야에서 널리 사용됩니다. 이는 제약, 생명공학, 학술 실험실에서 연구 개발을 가속화하는 다용도 도구입니다.
ClonePix 2 포유동물 콜로니 피커의 기능은 다른 콜로니 Screening 방법과 차별화되나요?
ClonePix 2 포유동물 콜로니 피커는 고급 Imaging 기술과 자동화된 콜로니 피킹을 결합하여 콜로니 Screening에 혁명을 일으켰습니다. 기존의 수동 방법과 달리 High-Throughput, 정밀도, 재현성을 제공합니다. 이 강력한 조합은 시간과 자원을 절약하는 동시에 클론 선택의 정확도를 향상시킵니다.
ClonePix 2 포유동물 콜로니 피커는 어떤 실험과정에 통합될 수 있나요?
ClonePix 2 포유동물 콜로니 피커는 단클론항체 생산, Cell Line Development, CRISPR/Cas9 유전체 편집, 재조합 단백질 발현을 포함한 다양한 실험과정에 원활하게 통합될 수 있습니다. 다재다능한 성능을 통해 연구자가 다운스트림 응용 분야에 가장 유망한 클론을 효율적으로 선택하여 이러한 실험과정을 최적화할 수 있습니다.
ClonePix 2 포유동물 콜로니 피커는 어떻게 과학 연구를 최적화할 수 있나요?
ClonePix 2 포유동물 콜로니 피커는 클론 스크리닝 과정을 간소화하여 과학 연구를 크게 개선시킵니다. 이를 통해 연구자가 고가치 클론을 신속하게 식별하고 선택할 수 있으므로 후속 실험에서 더 높은 성공률을 보장할 수 있습니다. 지루하고 시간이 많이 소요되는 콜로니 피킹 작업을 자동화함으로써 연구자가 더 중요한 활동에 집중할 시간을 확보하고 과학적 발견을 가속화합니다.
ClonePix 2 포유동물 콜로니 피커는 다양한 플레이트 형식을 처리할 수 있나요?
예, ClonePix 2 포유동물 콜로니 피커는 6Well, 12Well, 24Well, 48Well, 96Well 플레이트를 포함한 다양한 플레이트 형식과 호환됩니다. 이러한 유연성을 통해 연구자가 다양한 세포 밀도로 작업할 수 있으며 기존 실험 세팅에 이를 원활하게 통합할 수 있습니다.
ClonePix 2 포유동물 콜로니 피커는 클론 선택의 재현성을 어떻게 향상시키나요?
ClonePix 2 포유동물 콜로니 피커는 불일치와 오류가 발생할 수 있는 수동 콜로니 피킹의 주관적인 특성을 제거합니다. 과정을 자동화하여 기본 설정된 기준에 따라 정확하고 재현 가능한 피킹을 보장합니다. 이를 통해 실험 전반에 걸쳐 클론 선택의 일관성이 개선되고 연구 결과의 신뢰성이 향상됩니다.
최신 자료
제품 응용 분야
https://main--moleculardevices--hlxsites.hlx.page/fragments/applications/cell-line-development-2
https://main--moleculardevices--hlxsites.hlx.page/fragments/applications/hybridoma-screening
https://main--moleculardevices--hlxsites.hlx.page/fragments/applications/antigen-specific-screening
https://main--moleculardevices--hlxsites.hlx.page/fragments/applications/monoclonality-assurance
고객 사례 소개

당신의 다음 연구와 새로운 발견을 위해
어떤 도움이 필요하신가요?
뛰어난 역량의 직원들이 고객분들의 연구과제의 문제 해결을 위해 일선에서 대기하고 있습니다.
원격 또는 현장 제품 데모, 웨비나 등을 통해 도움을 받으실 수 있습니다. 무엇을 도와 드릴까요?
아래 항목 중에서 선택하십시오.